Indice
La corrente nei fluidi
L'elettrolisi
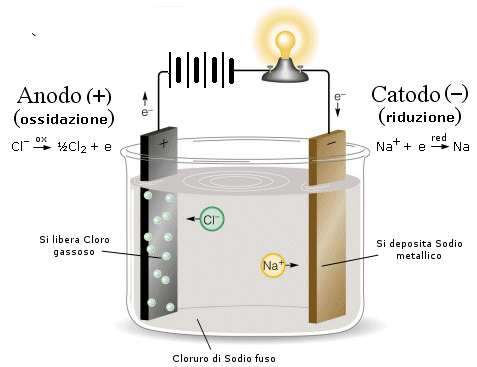
Per elettrolisi si intende quel processo in cui, a seguito del passaggio di corrente elettrica in una soluzione elettrolitica, si trasforma l’energia elettrica in energia chimica per effetto di reazioni di ossidoriduzione.
Collegati due elettrodi a un generatore, quello unito al polo positivo è l’anodo, l’altro è il catodo. Supponiamo di disciogliere $NaCl$ in soluzione; essendo un sale, si dissocia in $Na^+$ e $Cl^-$. Il campo elettrico presente porterà gli ioni $Na^+$ e gli ioni $Cl^-$ verso gli elettrodi di segno opposto, dando luogo alla seguenti reazioni:
| Anodo ($+$) | Catodo ($-$) |
|---|---|
| $2Cl^- \longrightarrow Cl_2 + 2e^-$ (ossidazione) | $2Na^+ + 2e^- \longrightarrow 2Na$ (riduzione, l'atomo di sodio si attacca al catodo) |
Complessivamente si ha una reazione in cui lo stato finale possiede un’energia superiore allo stato iniziale (reazione endoenergetica):
$$2NaCl \longrightarrow 2Na + Cl_2 (ossidoriduzione)$$
L’energia potenziale chimica in eccesso, che si accumula nell’$Na$ e nel $Cl_2$, è fornita dal generatore di corrente. Dunque dell’energia elettrica si è trasformata in energia chimica.
É bene ricordare che a partire dal secolo scorso, a seguito dello studio dei fenomeni elettrici nei liquidi ad opera di Michael Faraday, la chimica ebbe uno sviluppo notevole. Lo sfruttamento della forza elettrica nelle reazioni endotermiche consentì di sintetizzare in laboratorio molecole e composti fino ad allora sconosciuti.
Effetto Volta
Quando due metalli diversi sono posti a contatto tra di essi si instaura una differenza di potenziale (effetto Volta).
Leggi di Volta
- É possibile formare una catena di metalli diversi, ma la d.d.p. che si ottiene è la stessa che si avrebbe se il primo e l’ultimo fossero messi a diretto contatto.
- Se allora il primo e l’ultimo metallo della catena sono uguali non si ottiene alcuna d.d.p.
- Ma se nella stessa catena è presente una soluzione elettrolitica allora la d.d.p. viene ripristinata.
Alessandro Volta nel 1800 aveva messo in fila alcune decine di dischetti d’argento intervallati a dischi di zinco e di pezzi di pelle imbevuti di acido solforico, costruendo il suo apparato elettromotore che per ovvi motivi venne chiamato pila.
La pila di Volta
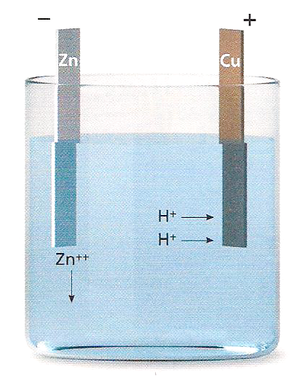
Una cella galvanica, come quelle messe in successione nella pila di Volta, può essere schematizzata come nella figura a fianco. Due metalli, ad esempio rame e zinco, si ionizzano in soluzione acquosa, rilasciando ioni positivi e assumendo quindi un potenziale negativo rispetto alla soluzione.
Lo zinco ha un potenziale di ionizzazione inferiore rispetto al rame, il che significa che esercita una forza minore sui propri elettroni di conduzione:
$$ \Delta V_{Zn} < \Delta V_{Cu} $$
Questo ci dice che lo zinco rilascia in soluzione più ioni positivi rispetto al rame, e pertanto il potenziale dell’elettrodo di zinco sarà inferiore a quello dell’elettrodo di rame. Infatti l'elettrodo di zinco sarà più carico di elettroni negativi avendo rilasciato in acqua un numero maggiore di ioni positivi.
Collegando i due elettrodi gli elettroni si muovono dal $–$ al $+$ cioè dallo zinco al rame. Una volta pareggiata la differenza di potenziale iniziale si ha equilibrio elettrostatico e quindi una corrente nulla nel circuito esterno.
Perché la corrente non si arresti è necessario riportare, all’interno della cella, la carica negativa dall’anodo ($Cu$) al catodo ($Zn$) facendo un lavoro contro le forze del campo elettrico a spese del calore sviluppato nella reazione di ossidoriduzione.
Immaginiamo quindi di sciogliere in soluzione dell'acido solforico ($H_2SO_4$), che si dissocia in ioni $2H^+$ e $SO_4^{--}$.
Nella seguente reazione lo zinco si ossida (cede due elettroni) e il rame si riduce (acquista due elettroni):
| Anodo (ossidazione) | Catodo (riduzione) |
|---|---|
| $Zn \longrightarrow Zn^{++}$ (che va in soluzione) $+ 2e^-$ (i due elettroni circolano nel circuito esterno) | |
| $Zn^{++} + SO_{4}^{--} \longrightarrow ZnSO_4$ (solfato di zinco) | $2H_3O^+$ (dalla dissociaz. dell’acido solforico) $+ 2e^- \longrightarrow H_2 + 2H_2O$ |
Complessivamente si ha la reazione di ossidoriduzione:
$$Zn + 2H_3O^+ \longrightarrow Zn^{++} + H_2$$
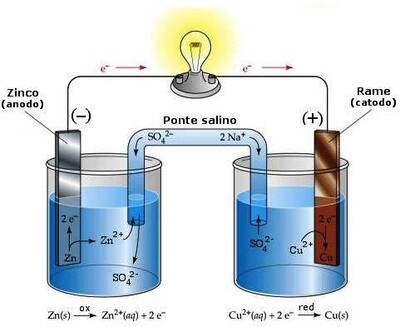
La pila di Daniell
Abbiamo un setto poroso, ad esempio di porcellana, che isola due soluzioni di $ZnSO_4$ e $CuSO_4$ , lasciando passare solo gli ioni $SO_4^{--}$.
| Anodo (ossidazione) | Catodo (Riduzione) |
|---|---|
| $Zn \longrightarrow Zn^{++} + 2e^-$ | $CuSO_4 \longrightarrow Cu^{++} + SO_4^{--}$ (che migra verso il catodo) |
| $Zn^{++} + SO_4^{--} \longrightarrow ZnSO_4$ | $Cu^{++} + 2e^-$ (del circuito) $\longrightarrow Cu$ (si attacca all’anodo) |
Quindi abbiamo che
$$Zn + Cu^{++} \longrightarrow Zn^{++} + Cu$$
Accumulatore a piombo
É la classica batteria di automobile. Consta di 6 coppie di elettrodi a forma di griglia posti in serie, come 6 pile che sommano la loro d.d.p. Il catodo è riempito di piombo ($Pb$) spugnoso, l’anodo di ossido di piombo ($PbO_2$). Essi sono immersi in una soluzione acquosa di acido solforico ($H_2SO_4$), che ovviamente si dissocia in acqua in $2H^+$ e $SO_4^{--}$.
L’accumulatore è in grado di funzionare sia come pila (fase di scarica) che come voltametro (fase di carica).
Nella fase di scarica:
| Anodo (ossidazione di $SO_4^{--}$ | Catodo (riduzione di $4H^+$ |
|---|---|
| $Pb + SO_4^{--}$ (in soluz.) $\longrightarrow PbSO_4 + 2e^-$ (vanno nel circuito) | $PbO_2 + 4H^+$ (in soluz.) $+ SO_4^{--}$ (in soluz.) $+2e^-$ (dal circuito) $\longrightarrow PbSO_4 + 2H_2O$ |
| Il solfato di piombo $PbSO_4$ si attacca all’elettrodo | Il solfato di piombo $PbSO_4$ si attacca all’elettrodo |
Sommando le due reazioni si ha:
$$Pb + PbO_2 + 2H_2SO_4 \longrightarrow 2PbSO_4 + 2H_2O (ossidoriduzione)$$
Si noti come 2 cariche negative si muovano complessivamente dal catodo (+) all'anodo (-) vincendo le forze del campo. Nella fase di scarica l’acido solforico ($H_2SO_4$) è consumato per produrre solfato di piombo ($PbSO_4$) che si deposita agli elettrodi. Lo scaricamento della pila è dovuto alla diminuzione della concentrazione di $H_2SO_4$.
Sappiamo però che collegando l’accumulatore a un generatore è possibile ricaricare la batteria, perché la reazione chimica di cui sopra può essere invertita per produrre nuovamente acido solforico ($H_2SO_4$) a spese del solfato di piombo ($PbSO_4$):
$$2PbSO_4 + 2H_2O \longrightarrow Pb + PbO_2 + 2H_2SO_4$$
In questo caso viene fornita energia all’accumulatore, che funziona come un voltametro. É bene tenere presente che, siccome i processi completamente reversibili non esistono in natura (2° principio della termodinamica), la nostra batteria non sarà mai più come nuova, ma dopo ogni ricarica risulterà un po’ più vecchia rispetto al caricamento precedente.
La forza elettromotrice di una pila
All’interno di un generatore le cariche si muovono contro natura, per effetto di una forza di tipo chimico che produce un lavoro che vince le forze del campo elettrico. Il lavoro fatto contro le forze del campo a spese dell’energia chimica è la f.e.m. della pila $L/\Delta q$, dove $L$ è il lavoro fatto e $\Delta q$ è la carica trasportata contro le forze del campo. La f.e.m. è anche uguale alla d.d.p. tra gli elettrodi se si trascura la resistenza interna del generatore.